Kontakt:Errol Zhou (Hr.)
Tlf.: plus 86-551-65523315
Mobil/WhatsApp: plus 86 17705606359
QQ:196299583
Skype:lucytoday@hotmail.com
E-mail:sales@homesunshinepharma.com
Tilføje:1002, Huanmao Bygning, Nr.105, Mengcheng Vej, Hefei By, 230061, Kina
TG Therapeutics er en biofarmaceutisk virksomhed dedikeret til at udvikle innovative behandlingsformer for patienter med B celle-medieret sygdomme. For nylig annoncerede virksomheden de positive top-line resultater af den globale fase III UNITY-CLL test. Forsøget blev udført hos patienter, som ikke tidligere havde fået behandling (primær behandling) og tilbagefald / ildfast (behandlet) kronisk lymfatisk leukæmi (CLL), og evaluerede effekten og sikkerheden af det kombinerede regime umbralisib og ublituximab (U2) og Sammenlignet med obinutuzumab + chlorambucilopløsning.
Forsøget blev udført i henhold til Special Program Evaluation (SPA) aftale med FDA. Resultaterne viste, at studiet havde nået det primære endepunkt i den præspecificerede interimanalyse: Ifølge den uafhængige vurderingskomité (IRC) havde U2-behandlingsgruppen ingen progression i overlevelse (PFS) En statistisk signifikant forbedring (p<0.0001) was="" achieved,="" and="" treatment="" benefits="" were="" observed="" in="" both="" the="" previously="" untreated="" (initial="" treatment)="" and="" relapsed="" refractory="" (treated)="" cll="" patient="">
På grund af sin fremragende effekt vil forsøget blive afsluttet tidligt efter anbefaling fra Independent Data Safety Monitoring Board (DSMB). Ifølge data fra forsøget, TG planer om at indsende en U2 regime for regulerende ansøgninger om CLL patienter, der ikke tidligere har modtaget behandling (indledende behandling) og tilbagefald / refractory (behandlet) CLL patienter ved udgangen af 2020.
Umbralisib er en oral, en gang dagligt, ny generation PI3Kδ hæmmer, der entydigt hæmmer CK1-ε, hvilket kan gøre det muligt at overvinde nogle af de toleranceproblemer, der er forbundet med den første generation AF PI3Kδ-inhibitor. ublituximab er en roman glycoengineered anti-CD20 monoklonal antistof, der er rettet mod en unik epitop af CD20 antigen på modne B lymfocytter.
Hvis det godkendes, vil U2 give et nyt, ikke-kemoterapiregime til CLL-patienter, som ikke tidligere har fået behandling (indledende behandling), og CLL-patienter, som har fejlet eller tilbagefaldt til tidligere behandlinger.
Kronisk lymfatisk leukæmi (CLL) er den mest almindelige form for voksen leukæmi. Det anslås, at i 2020, mere end 20.000 nye tilfælde af CLL vil blive diagnosticeret i USA. Selv om symptomerne på CLL kan forsvinde i nogen tid efter den indledende behandling, sygdommen anses for uhelbredelig, og mange mennesker vil kræve yderligere behandling på grund af gentagelse af maligne celler.
John Gribben, MD, professor i medicinsk onkologi, Barts Cancer Institute, London, UK, sagde: "Vi er meget glade for at se, at dette vigtige forsøg er i første linje og tilbagefald / ildfaste CLL patienter Kombinationen af umbralisib og ublituximab har opnået positive resultater. Dagens resultater markerer det første vellykkede kliniske fase III-forsøg baseret på PI3Kδ-behandlingsregimet i CLL-patientpopulationen, herunder patienter, som ikke tidligere har fået behandling. På nuværende tidspunkt, CLL er stadig Der er ingen kur, og der er stadig et presserende behov for nye behandlingsmuligheder, især dem, der giver forskellige mekanismer og sikre behandlingsmuligheder. "

ublituximab er en ny type glycoengineered anti-CD20 monoklonalt antistof, der er rettet mod den unikke epitop af CD20-antigen på modne B-lymfocytter. Denne epitop er forskellig fra mange CD20 monoklonale antistoffer i øjeblikket på markedet, herunder ofatumumab, ocrelizumab / rituximab, obinutuzumab (GA101).
I øjeblikket, ublituximab er i fase III klinisk udvikling til behandling af multipel sklerose (MS) og kronisk lymfocytisk leukæmi (CLL).

Umbralisib er en dobbeltvirkende hæmmer af fosforinositide-3-kinase δ (PI3Kδ) og kaseinkinase 1ε (CK-1ε), som kan gøre det muligt at overvinde nogle af de toleranceproblemer, der er forbundet med førstegenerationsPI3Kδ-hæmmere. Phosphatidylinositol-3 kinase (PI3K) er en klasse af enzymer, der er involveret i forskellige cellulære funktioner såsom celleproliferation og overlevelse, celledferentiering, intracellulær transport og immunitet. PI3K har fire undertyper (α, β, δ og γ), hvoraf δ-subtype udtrykkes kraftigt i hæmatopoietiske celler, ofte forbundet med B-cellerelateret lymfom.
Umbrasib har nanomolar potens mod δ-undertypen PI3K og har høj selektivitet over for undertyperne α, β og γ. Umbralisib hæmmer også entydigt kaseinkinase 1-ε (CK1-ε), som kan have en direkte anti-cancer effekt, og kan også modulere T-celleaktivitet forbundet med immunmedierede bivirkninger, der tidligere er observeret i PI3K-hæmmere.
De aktuelt godkendte PI3Kδ-hæmmere er forbundet med autoimmunitmedieret toksicitet, såsom hepatotoksicitet, lungetoksicitet og colitis. Sammenlignet med de godkendte PI3K-hæmmere kan umbralisibs specifikke forskelle, dens unikke hæmmende virkning på CK1-ε og dens unikke og patenterede kemiske struktur have differentierede egenskaber i PI3K-inhibitorklassen.
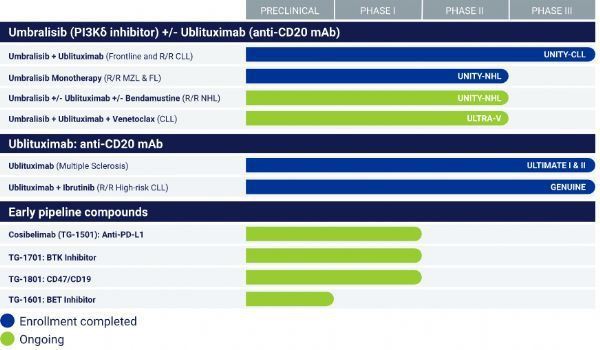
I januar i år, TG begyndte at indsende en ny lægemiddelansøgning (NDA) til den amerikanske FDA, søger fremskyndet godkendelse af umbralisib for patienter med tidligere behandlet marginal zone lymfom (MZL) og follikulært lymfom (FL).
Tidligere har FDA givet fire sjældne lægemiddelkvalifikationer (ODD) for umbralisib, herunder FL og alle tre MZLs (lymfeknuder, ekstralymph noder, og milt MZL). Desuden gav FDA umbralisib et gennembrud lægemiddel kvalifikation (BTD) til behandling af voksne patienter med recidiverende eller ildfast MZL, der tidligere havde modtaget mindst én anti-CD20 behandling.