Kontakt:Errol Zhou (Hr.)
Tlf.: plus 86-551-65523315
Mobil/WhatsApp: plus 86 17705606359
QQ:196299583
Skype:lucytoday@hotmail.com
E-mail:sales@homesunshinepharma.com
Tilføje:1002, Huanmao Bygning, Nr.105, Mengcheng Vej, Hefei By, 230061, Kina
Marinus Pharma er en farmaceutisk virksomhed dedikeret til at udvikle innovative terapier til behandling af epilepsisygdomme. For nylig meddelte virksomheden, at European Medicines Agency (EMA) Committee for Medicinal Products for Human Use (CHMP) har godkendt en anmodning om fremskyndet evaluering af sin ledende lægemiddelkandidat ganaxolon til behandling af epileptiske anfald forbundet med CDKL5 -mangel (CDD). Det er en sjælden arvelig epilepsi.
Når et farmaceutisk produkt forventes at have betydelige fordele for folkesundheden og terapeutisk innovation, vil CHMP give en accelereret evaluering. Når ansøgningen om markedsføringstilladelse (MAA) er indsendt og verificeret, kan den hurtige evaluering forkorte gennemgangstiden fra 210 dage til 150 dage.
I begyndelsen af august indsendte Marinus en New Drug Application (NDA) til US Food and Drug Administration (FDA) til brug af ganaxolon til behandling af CDD-relaterede anfald. Marinus har anmodet FDA om at foretage en prioriteret gennemgang. FDA vil udstede et NDA -anmeldelsesbrev inden udgangen af tredje kvartal af 2021.
CDKL5-mangel (CDD) er en alvorlig og sjælden genetisk sygdom forårsaget af mutationer i det cyclinafhængige kinase-lignende 5 (CDKL5) -gen placeret på X-kromosomet. CDD er kendetegnet ved tidlig debut, besværlige at kontrollere anfald og stærkt svækket neurodevelopment. I øjeblikket er der ingen godkendt behandling specifikt til CDD.
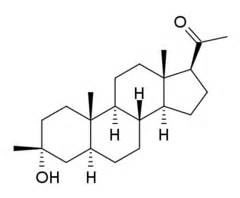
Ganaxolon kemisk struktur
Ganaxolone er en positiv allosterisk modulator af GABAA -receptorer. Intravenøse og orale præparater udvikles i øjeblikket for at maksimere behandlingsområdet for voksne og pædiatriske patienter i akutte og kroniske plejeindstillinger. Ganaxolone udøver anti-epileptiske og angstdæmpende aktiviteter ved at virke på synapser og ekstrasynaptiske GABAA-receptorer. I mere end 2 år har ganaxolon undersøgt forskellige indikationer, behandlingsrelaterede dosisniveauer og behandlingsplaner hos mere end 1.800 børn og voksne forsøgspersoner.
Ansøgningen om markedsføringstilladelse (MAA) for ganaxolon til behandling af CDD-relaterede anfald understøttes af data fra fase 3 Marigold-forsøget. Dette er et dobbeltblindt placebokontrolleret forsøg udført på 101 patienter. I forsøget blev medianfrekvensen af større motoriske anfald i ganaxolonbehandlingsgruppen reduceret med 30,7% over 28 dage, mens placebogruppen blev reduceret med 6,9% og nåede forsøgets primære endepunkt (p=0,0036). I Marigold open-label forlængelsesundersøgelsen reducerede patienter, der fik ganaxolon i mindst 12 måneder (n=48), medianfrekvensen af større motoriske anfald med 49,6%. I dette fase 3 -forsøg blev ganaxolon generelt godt tolereret, og dets sikkerhed var i overensstemmelse med tidligere kliniske forsøg. Den mest almindelige bivirkning var døsighed.
Kimberly McCormick, Marinus Senior Vice President og Head of Regulatory Affairs, sagde: ”Vi mener, at EMAs fremskyndede evaluering fremhæver ganaxolons potentiale til at imødegå de uopfyldte medicinske behov hos CDD -patienter og familier. Vi planlægger at indsende en ansøgning om markedsføringstilladelse (MAA) inden udgangen af tredje kvartal. ) Og ser frem til at samarbejde med EMA under gennemgang af ansøgningen fra EMA. Hvis det godkendes, vil vores samarbejde med Orion støtte os i at bringe ganaxolon til det europæiske marked så hurtigt som muligt til gavn for CDD -patienter."